Lancet子刊│中国细胞治疗技术发展综述(下)中国细胞治疗的历史和当前监管改革
• 更新时间:2023-03-20 •阅读

中国细胞治疗的历史和当前监管改革
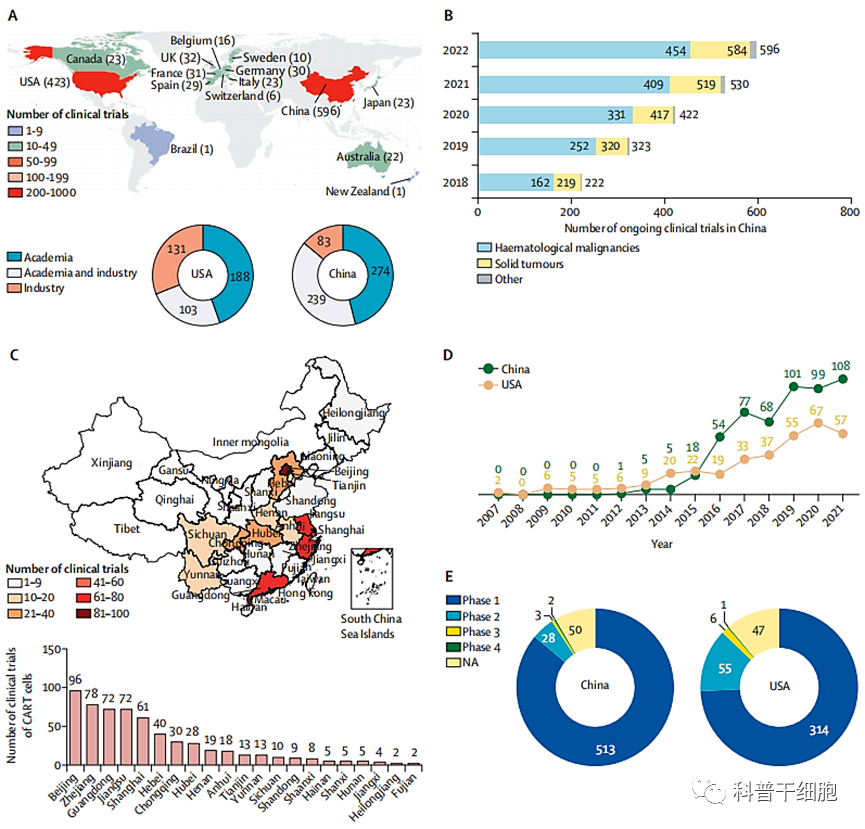
随着全球批准的细胞治疗产品的日益商业化,中国政府发布了一系列相关政策,以促进细胞治疗在中国的规范发展和标准化。

本文由湖南云上细胞科技有限公司发布,部分素材来源网络,如有侵权请联系我们删除,转载联系作者并注明出处:http://www.xbgtt.com/zaishengyixue/1299.html

中国细胞治疗的历史和当前监管改革
随着全球批准的细胞治疗产品的日益商业化,中国政府发布了一系列相关政策,以促进细胞治疗在中国的规范发展和标准化。


本文由湖南云上细胞科技有限公司发布,部分素材来源网络,如有侵权请联系我们删除,转载联系作者并注明出处:http://www.xbgtt.com/zaishengyixue/1299.html